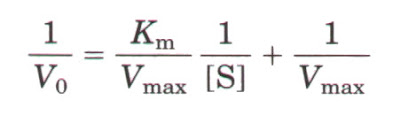Ecuación de Lineweaver-Burk
Existe otra representación de la cinética enzimática aparte de la ecuación de Michaelis-Menten, conocida como diagrama de Lineweaver-Burk, que es más práctico para calcular los parámetros cinéticos de una enzima. En esta representación se grafica el inverso de los valores de la cinética de Michaelis-Menten, lo que da como resultado una linea recta con la siguiente ecuación.
La ecuación de Lineweaver-Burk se usa para determinar los valores de Km y Vmax. En la gráfica, el punto donde la línea intersecta al eje Y es el valor inverso de Vmax, mientras que el punto donde la linea corta al eje X representa el valor inverso de Km.
Con este tipo de gráfica también se puede visualizar el comportamiento de una enzima en presencia de un inhibidor. Si se trata de un inhibidor competitivo, observaremos que la linea intersecta al eje Y en el mismo punto que la linea que representa la cinética sin inhibidor, es decír, que no se modifica el valor de la Vmax, pero sí vemos un cambio en la valor de Km (linea azul). Por otro lado, si se trata de un inhibidor no competitivo, el valor de Km no cambia pero si lo hace la Vmax (linea roja).
A pesar de la practicidad matemática de la ecuación, pequeños errores experimentales pueden afectar enormemente a la inclinación de la linea (debido a que se grafican los valores inversos) llevando a una asignación de valores de Km y Vmax equivocados. La máxima utilidad que tuvo esta ecuación fue en la época en que no se disponía de computadoras potentes que pudieran resolver los parámetros de la ecuación de Michaelis-Menten. Visita también nuestro tema de divulgación científica: Hablando de Enzimas.
Ir al tema siguiente: Introducción al metabolismo.
Ir al tema anterior: Cinética enzimática.
Ir al: TEMARIO COMPLETO DE BIOQUÍMICA.
La ecuación de Lineweaver-Burk se usa para determinar los valores de Km y Vmax. En la gráfica, el punto donde la línea intersecta al eje Y es el valor inverso de Vmax, mientras que el punto donde la linea corta al eje X representa el valor inverso de Km.
Con este tipo de gráfica también se puede visualizar el comportamiento de una enzima en presencia de un inhibidor. Si se trata de un inhibidor competitivo, observaremos que la linea intersecta al eje Y en el mismo punto que la linea que representa la cinética sin inhibidor, es decír, que no se modifica el valor de la Vmax, pero sí vemos un cambio en la valor de Km (linea azul). Por otro lado, si se trata de un inhibidor no competitivo, el valor de Km no cambia pero si lo hace la Vmax (linea roja).
A pesar de la practicidad matemática de la ecuación, pequeños errores experimentales pueden afectar enormemente a la inclinación de la linea (debido a que se grafican los valores inversos) llevando a una asignación de valores de Km y Vmax equivocados. La máxima utilidad que tuvo esta ecuación fue en la época en que no se disponía de computadoras potentes que pudieran resolver los parámetros de la ecuación de Michaelis-Menten. Visita también nuestro tema de divulgación científica: Hablando de Enzimas.
Ir al tema siguiente: Introducción al metabolismo.
Ir al tema anterior: Cinética enzimática.
Ir al: TEMARIO COMPLETO DE BIOQUÍMICA.
Temas Selectos de Ciencias.
La Bioquímica vista en 3D
La Bioquímica vista en 3D
Ir al MAPA DEL SITIO para ver contenido de otras áreas (Bioquímica, Inmunología, Biología...)