Inmunoglobulina A Secretoria, SIgA
La Inmunoglobulina A (IgA) es un anticuerpo importante que se encuentra en los revestimientos mucosos de los sistemas respiratorio, gastrointestinal y genitourinario. Es una de las cinco clases de inmunoglobulinas (las otras son IgG, IgM, IgE e IgD). La IgA es el anticuerpo más abundante que se encuentra en las superficies mucosas y representa la primera línea de defensa contra antígenos extraños, por lo que juega un papel clave de la respuesta inmune, ya que en humanos (por ejemplo) las membranas mucosas generan unos 400 m2 cuadrados de superficie donde se pueden instalar incontables bacterias y otros antígenos.
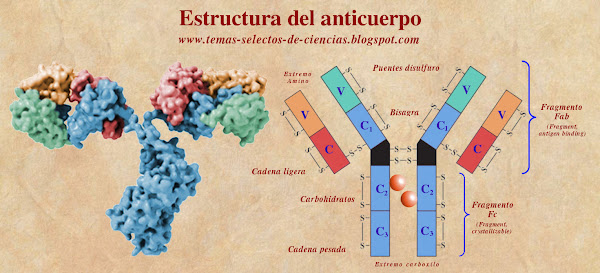
La IgA es un tipo de inmunoglobulina producida por los Linfocitos B y secretada en las mucosas del cuerpo. Cada molécula de IgA se compone de dos cadenas pesadas y dos cadenas ligeras unidas por enlaces disulfuro. Sin embargo, la forma más común de IgA tiene una estructura molecular de tipo dimérica, en la que dos moléculas de anticuerpos se encuentran unidas por un segmento adicional ubicado en la región constante C3. Esto le permite unirse a los antígenos y aglunitarlos (aglomerarlos), evitando así que se adhieran a los tejidos y los colonicen. Una vez aglutinados, los antígenos pueden ser eliminados por movimientos de peristalsis de las mucosas o por el movimiento del moco por las células ciliadas, fenómeno denominado exclusión inmune. Además, la IgA ayuda a neutralizar los antígenos, lo que los hace menos propensos a causar una infección. El mecanismo de neutralización de antígenos consiste en unirse a estructuras o moléculas que son necesarias para el proceso patológico del antígeno, por ejemplo, proteínas de unión a receptores de célula blanco; de esta manera impiden que el antígeno lleve a cabo su función patógena (queda neutralizado).
La molécula de inmunoglobulina A está compuesta por dos regiones llamadas Fab (del inglés: Fragment antigen binding, fragmento de unión a antígeno), que están conectadas por una región denominada bisagra. Las regiones Fab contienen los sitios de unión al antígeno y están compuestas por dos dominios de tipo inmunoglobulina, cada uno de los cuales está compuesto por una cadena pesada y una ligera. Las cadenas pesada y ligera se mantienen unidas por puentes disulfuro e interacciones no covalentes. Las cadenas pesadas constan de cuatro dominios, mientras que las cadenas ligeras constan de dos dominios. Las dos regiones Fab forman una estructura en forma de "Y" y la zona de la bisagra conecta las dos regiones Fab con las zonas constantes.
Los sitios de unión al antígeno de IgA están ubicados en las puntas de la estructura en forma de "Y". Estos sitios de unión al antígeno están compuestos por residuos de aminoácidos de las cadenas pesada y ligera, y son responsables de reconocer y unirse a antígenos específicos. Los sitios de unión a antígeno de IgA son muy variables, lo que permite que la IgA reconozca y se una a una amplia variedad de antígenos.
La molécula de IgA también contiene un componente secretor, que es responsable de transportar a la IgA a través de las membranas de las células de las mucosas. El componente secretor es un polipéptido que se une a la molécula de IgA mediante puentes disulfuro. Este se une a moléculas receptoras específicas en las superficies de las células de las mucosas, lo que le permite ser transportado a través de la membrana y ser secretado en el lado opuesto de la célula. La IgA secretada se conoce como Inmunoglobulina A secretoria, abreviada como SIgA.
La SIgA es un anticuerpo altamente eficaz, esencial para la defensa contra una amplia gama de microbios en tejidos mucosos como las vías respiratorias, gastrointestinales y genitourinarias, así como en la saliva y las lágrimas, ayudando a prevenir la adhesión y entrada de virus y bacterias en el cuerpo.
Se cree que el componente secretor de SIgA está involucrado en varios procesos relacionados con el transporte, incluida la protección contra la degradación proteolítica, la unión del anticuerpo a las superficies mucosas y la mejora del transporte de SIgA a través de la membrana mucosa. En general, el componente secretor de SIgA es una parte importante de la molécula de anticuerpo y desempeña un papel fundamental en el transporte, desde las células plasmáticas a las superficies mucosas, y la regulación de los anticuerpos de isotipo A.
En algunos mamíferos, como humanos y primates, existen dos formas de IgA secretoria (SIgA), llamadas SIgA1 y SIgA2, secretadas en las mucosas. Estas dos formas difieren en el número de aminoácidos, la SIgA2 es 13 aminoácidos más corta. Esta diferencia se ubica en la zona de la bisagra y confiere a la SIgA2 una resistencia a la degradación por enzimas secretadas por bacterias, ya que el espacio accesible para las proteasas es menor y no logran alcanzar el sitio de corte ubicado en la bisagra. De esta manera, la presencia de la SIgA2 representa una ventaja en la lucha contra bacterias presentes en las mucosas.
Finalmente, la SIgA tiene un papel en el desarrollo de la tolerancia a las alergias alimentarias. La tolerancia se refiere a la capacidad del cuerpo para reconocer y aceptar antígenos sin generar una respuesta inmunitaria agresiva. La SIgA ayuda a promover la tolerancia al unirse a los antígenos y al regular el sistema inmunológico. Al hacer esto, permite reducir el riesgo de que el cuerpo reaccione de forma exagerada a los antígenos en mucosas y provoque una respuesta autoinmune.
BIBLIOGRAFIA
Pier, J., Liu, E. G., Eisenbarth, S., & Järvinen, K. M. (2021). The role of immunoglobulin A in oral tolerance and food allergy. Annals of Allergy, Asthma & Immunology, 126(5), 467-468.
Marcotte, H., & Lavoie, M. C. (1998). Oral microbial ecology and the role of salivary immunoglobulin A. Microbiology and molecular biology reviews, 62(1), 71-109.
La IgA es un tipo de inmunoglobulina producida por los Linfocitos B y secretada en las mucosas del cuerpo. Cada molécula de IgA se compone de dos cadenas pesadas y dos cadenas ligeras unidas por enlaces disulfuro. Sin embargo, la forma más común de IgA tiene una estructura molecular de tipo dimérica, en la que dos moléculas de anticuerpos se encuentran unidas por un segmento adicional ubicado en la región constante C3. Esto le permite unirse a los antígenos y aglunitarlos (aglomerarlos), evitando así que se adhieran a los tejidos y los colonicen. Una vez aglutinados, los antígenos pueden ser eliminados por movimientos de peristalsis de las mucosas o por el movimiento del moco por las células ciliadas, fenómeno denominado exclusión inmune. Además, la IgA ayuda a neutralizar los antígenos, lo que los hace menos propensos a causar una infección. El mecanismo de neutralización de antígenos consiste en unirse a estructuras o moléculas que son necesarias para el proceso patológico del antígeno, por ejemplo, proteínas de unión a receptores de célula blanco; de esta manera impiden que el antígeno lleve a cabo su función patógena (queda neutralizado).
La molécula de inmunoglobulina A está compuesta por dos regiones llamadas Fab (del inglés: Fragment antigen binding, fragmento de unión a antígeno), que están conectadas por una región denominada bisagra. Las regiones Fab contienen los sitios de unión al antígeno y están compuestas por dos dominios de tipo inmunoglobulina, cada uno de los cuales está compuesto por una cadena pesada y una ligera. Las cadenas pesada y ligera se mantienen unidas por puentes disulfuro e interacciones no covalentes. Las cadenas pesadas constan de cuatro dominios, mientras que las cadenas ligeras constan de dos dominios. Las dos regiones Fab forman una estructura en forma de "Y" y la zona de la bisagra conecta las dos regiones Fab con las zonas constantes.
Los sitios de unión al antígeno de IgA están ubicados en las puntas de la estructura en forma de "Y". Estos sitios de unión al antígeno están compuestos por residuos de aminoácidos de las cadenas pesada y ligera, y son responsables de reconocer y unirse a antígenos específicos. Los sitios de unión a antígeno de IgA son muy variables, lo que permite que la IgA reconozca y se una a una amplia variedad de antígenos.
La molécula de IgA también contiene un componente secretor, que es responsable de transportar a la IgA a través de las membranas de las células de las mucosas. El componente secretor es un polipéptido que se une a la molécula de IgA mediante puentes disulfuro. Este se une a moléculas receptoras específicas en las superficies de las células de las mucosas, lo que le permite ser transportado a través de la membrana y ser secretado en el lado opuesto de la célula. La IgA secretada se conoce como Inmunoglobulina A secretoria, abreviada como SIgA.
La SIgA es un anticuerpo altamente eficaz, esencial para la defensa contra una amplia gama de microbios en tejidos mucosos como las vías respiratorias, gastrointestinales y genitourinarias, así como en la saliva y las lágrimas, ayudando a prevenir la adhesión y entrada de virus y bacterias en el cuerpo.
Se cree que el componente secretor de SIgA está involucrado en varios procesos relacionados con el transporte, incluida la protección contra la degradación proteolítica, la unión del anticuerpo a las superficies mucosas y la mejora del transporte de SIgA a través de la membrana mucosa. En general, el componente secretor de SIgA es una parte importante de la molécula de anticuerpo y desempeña un papel fundamental en el transporte, desde las células plasmáticas a las superficies mucosas, y la regulación de los anticuerpos de isotipo A.
En algunos mamíferos, como humanos y primates, existen dos formas de IgA secretoria (SIgA), llamadas SIgA1 y SIgA2, secretadas en las mucosas. Estas dos formas difieren en el número de aminoácidos, la SIgA2 es 13 aminoácidos más corta. Esta diferencia se ubica en la zona de la bisagra y confiere a la SIgA2 una resistencia a la degradación por enzimas secretadas por bacterias, ya que el espacio accesible para las proteasas es menor y no logran alcanzar el sitio de corte ubicado en la bisagra. De esta manera, la presencia de la SIgA2 representa una ventaja en la lucha contra bacterias presentes en las mucosas.
Finalmente, la SIgA tiene un papel en el desarrollo de la tolerancia a las alergias alimentarias. La tolerancia se refiere a la capacidad del cuerpo para reconocer y aceptar antígenos sin generar una respuesta inmunitaria agresiva. La SIgA ayuda a promover la tolerancia al unirse a los antígenos y al regular el sistema inmunológico. Al hacer esto, permite reducir el riesgo de que el cuerpo reaccione de forma exagerada a los antígenos en mucosas y provoque una respuesta autoinmune.
Temas Selectos de Ciencias.
Sistema Inmunitario, reconociendo lo propio de lo ajeno.
Sistema Inmunitario, reconociendo lo propio de lo ajeno.
Ir al MAPA DEL SITIO para ver contenido de otras áreas (Bioquímica, Inmunología, Biología...)
BIBLIOGRAFIA
Pier, J., Liu, E. G., Eisenbarth, S., & Järvinen, K. M. (2021). The role of immunoglobulin A in oral tolerance and food allergy. Annals of Allergy, Asthma & Immunology, 126(5), 467-468.
Marcotte, H., & Lavoie, M. C. (1998). Oral microbial ecology and the role of salivary immunoglobulin A. Microbiology and molecular biology reviews, 62(1), 71-109.





Comentarios
Publicar un comentario