El Sistema del Complemento
El Sistema del Complemento, también llamado "Cascada del Complemento", es una serie de reacciones enzimáticas que ocurren en "cascada" (es decir, que unas proteínas activan a otras) y que culmina con la formación de un poro en la superficie de los antígenos, típicamente bacterias. Representa una de las principales lineas de defensa contra microorganismos y es uno de los puntos que conecta la respuesta inmune innata con la adaptativa. Se estima que se originó en los animales hace más de 500 millones de años.
Se denomina así debido a unos estudios hechos en la década de 1980 donde se observó que había ciertas proteínas, diferentes de los anticuerpos, que participaban en la destrucción de bacterias de Vibrio cholerae. A estas proteínas se les llamó "Complemento", ya que complementaban la función de los anticuerpos, es decir, los anticuerpos eran capaces de unirse a las bacterias pero incapaces de destruirlos, mientras que las proteínas del complemento sí podían destruir a las bacterias.
Actualmente conocemos los mecanismos y detalles de toda esta cascada del complemento, sabemos que también participa en otros procesos, como la inflamación, y está relacionada estrechamente con la respuesta inmune innata y adaptativa. Como veremos a detalle más adelante, la cascada del complemento puede ser iniciada por otras proteínas diferentes de los anticuerpos como las proteínas de fase aguda y receptores de reconocimiento de patrones moleculares asociados a patógenos (PAMP's, por sus siglas en inglés Pathogen Associated Molecular Patterns ).
El Sistema del Complemento comprende unas 40 proteínas que se encuentran en el plasma o unidas a la membrana de las células. Son producidas en el hígado y por algunos macrófagos activados durante el proceso de inflamación. Otras células capaces de producir proteínas del Complemento en un determinado momento incluyen a Monocitos sanguíneos y algunas células epiteliales de mucosas. Las proteínas se producen en sus formas inactivas y requieren de la participación de otras enzimas para activarse mediante la eliminación de una porción o fragmento.
Los componentes del Sistema del Complemento se designan con la letra "C" y un número, por ejemplo C1, C2, C3, etc., hasta C9. A algunas de ellas les denomina "factores", por ejemplo el "factor B" o el "factor D". A los fragmentos que se forman por la activación de algún componente se les designa con una letra minúscula, por ejemplo "C3a" o "C5b". En la mayoría de las proteínas, los fragmentos designados con la letra "a" son pequeños y solubles, mientras que los denominados con las letras "b" son grandes y se pueden adherir a la superficie de los antígenos.
Es importante señalar que durante muchos años se consideró una excepción con la proteína C2, donde el fragmento "C2a" era el grande y el "C2b" era el pequeño. Esto ha causado mucha confusión a lo largo de los años, por lo que se ha propuesto cambiar la designación, es por eso que algunos textos y artículos ya manejan a "C2a" como el fragmento pequeño y a "C2b" como el grande [Bohlson, et tal, 2019]. Sin embargo, este cambio aún no está universalmente aceptado, por lo que en algunos documentos aún se maneja a C2a como el fragmento grande y C2b como el pequeño. Nosotros lo manejaremos como lo marca la propuesta: C2a como fragmento pequeño y C2b como fragmento grande.
Las proteínas del Complemento participan en cuatro funciones que son: lisis de células bacterianas, opsonización de antígenos, activación de la respuesta inflamatoria y limpieza de complejos antígeno-anticuerpo.
El poro formado al final de la Cascada del Complemento tiene un diámetro interno de unos 100 ángstroms (100 Å, un ángstroms equivale a 1x10-9 metros), suficiente para que las moléculas pequeñas como la glucosa, aminoácidos, iones, ATP, etc., puedan salir de la célula y causar un colapso metabólico que termina matando a la célula. Se piensa que la enzima lisozima que degrada el peptidoglucano de la pared celular de las bacterias podría pasar por el poro formado en la membrana externa de las bacterias Gram-negativas y acceder a la pared celular, sin embargo es necesaria más evidencia al respecto.
A pesar de que hablamos de "la formación del poro" sobre la membrana celular, en realidad se forman miles o incluso millones de ellos sobre la superficie en la que se activó el sistema del complemento, de tal manera que la célula queda literalmente "llena de hoyos".
Durante la Cascada del Complemento, se generan proteínas activas que tienen la capacidad de unirse a la superficie del antígeno, las principales son C3b y C5b. Debido a que el Sistema del Complemento se activa en forma de cascada, en un momento dado se han producido miles de millones de proteínas activas C3b y C5b, muchas de estas se quedan unidas a la superficie de los antígenos.
Existen otras proteínas capaces de llevar a cabo el proceso de opsonización. Los más importantes son los anticuerpos que, al estar presentes en grandes cantidades, son capaces de unirse a los antígenos. Las células fagocíticas como Macrófagos, Células Dendríticas, Neutrófilos, entre otros, reconocen a las proteínas que están opsonizando a los antígenos y los fagocitan.
El mecanismo más eficiente para la eliminación de complejos antígeno-anticuerpo es mediante la fagocitosis llevada a cabo por células del sistema inmune que se encuentran patrullando el organismo. Sin embargo, existe otro mecanismo de eliminación de estos complejos mediada por la participación el Sistema del Complemento. Cuando se forman los complejos Ag-Ab, algunas proteínas del Complemento favorecen la unión de estos complejos a la superficie de los glóbulos rojos que en algún momento de su trayecto pasarán por bazo, en donde liberarán los complejos Ag-Ab para que puedan ser fagocitados por los macrófagos esplénicos (macrófagos del bazo).
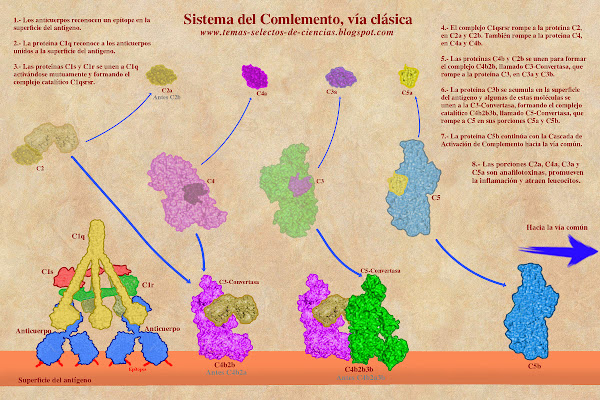
La Vía Clásica de activación del Complemento fue la primera que se descubrió, por eso se le denomina "clásica". Inicia cuando anticuerpos, normalmente de isotipos IgM o IgG, se unen a la superficie de algún antígeno que han reconocido. La activación de esta vía requiere que varios anticuerpos se encuentren muy cerca unos de otros sobre la superficie del antígeno. En este sentido, la IgM al ser pentamérica, representa el principal anticuerpo capas de activar al Complemento por la vía clásica, mientras que la IgG es el anticuerpo más abundante en el plasma por lo que hay suficiente para activar al Complemento. La formación de este complejo Antígeno-Anticuerpo es reconocido por una proteína del Complemento denominada "C1q".
La cascada de activación por la vía clásica también se puede activar de otras maneras, aunque en menor proporción. La presencia de la Proteína C Reactiva, Proteína Amilóide Sérica, fibras amilóides así como cuerpos apoptóticos pueden activar la Vía Clásica.
La proteína C1q tiene una forma simétrica con seis brazos distribuidos de manera helicoidal cuyas puntas se unen a los dominios CH2 de los anticuerpos. La C1q permite que se unan otras dos proteínas llamadas "C1s" y "C1r", estas dos son enzimas proteasas que se activan la una a la otra, de hecho son dos enzimas de C1s y dos de C1r. La unión de todas estas proteínas forma un complejo denominado "C1qs2r2" (también C1qsrsr) cuya estabilidad requiere de la presencia de iones de Calcio.
El complejo C1qsrsr tiene actividad catalítica de tipo proteasa y es capaz de romper a otras proteínas del Complemento para activarlas. Una de ellas es la proteína C2 (que se rompe en un fragmento grande llamado C2b y fragmento pequeño llamado C2a*), y la otra es la C4 (que se rompe en un fragmento grande llamado C4b y fragmento pequeño llamado C4a). El número asignado a las proteínas del complemento está en función de su descubrimiento y no necesariamente refleja el orden en el que funcionan.
Los fragmentos pequeños C2a y C4a difunden por el plasma y funcionan como mediadores de inflamación, mientras que los fragmentos grandes C2b y C4b se unen para formar un complejo proteico que también tiene actividad enzimática. Este complejo se denomina "C4bC2b"* pero para simplificar un poco la nomenclatura se le conoce como "C4b2b" y la función que tiene es romper a la proteínas del complemento "C3", por lo que también recibe el nombre de "C3-Convertasa" o "Convertasa de C3".
* recordemos que anteriormente se denominaba C2a al fragmento grande, por lo que la convertasa de C3 solía denominarse como C4bC2a o C4b2a.
La Convertasa de C3 rompe a la proteína C3 en un fragmento pequeño "C3a" y uno grande "C3b". El fragmento C3a difunde en el plasma y funciona como molécula quimio-atractora de Neutrófilos, Macrófagos y Linfocitos, además de ser un potente activador de Mastocitos, influyendo de esta manera en el proceso inflamatorio, razón por la que a estas proteínas se les conoce como anafilotoxinas. El fragmento C3b se acumula en la proximidad del sitio en donde se activó la Vía Clásica mediante C1q. Esta proteína C3b se une a la superficie del antígeno y funciona como opsonina. La acumulación de la C3b favorece que algunas de estas moléculas se unan al complejo catalítico C4b2b (C3 Convertasa), generando un complejo más grande denominado "C4b2b3b" cuya función es romper a la proteína "C5" por lo que recibe el nombre de "C5-Convertasa" o "Convertasa de C5".
La ruptura de la proteína C5 por la C5-Convertasa genera dos fragmentos, uno pequeño denominado "C5a" (que difunde y actúa igual que C3a) y un fragmento grande llamado "C5b" que se adhiere a la superficie del antígeno y participa en el resto de la Cascada del Complemento hasta formar el poro que se mencionó al inicio de esta página. Este poro se conoce como Complejo de Ataque a Membrana o MAC (por sus siglas en inglés Membrane Attack Complex).
Se requieren de 10 a 17 proteínas C9 para formar un sólo Complejo de Ataque a Membrana. Además, cada complejo catalítico de C5-Convertasa producirá cientos de miles de proteínas C5b, cada una de ellas con el potencial de formar un MAC. Recordemos también que se han formado múltiples Convertasas de C3, lo que magnifica enormemente la formación del MAC a partir de una sola molécula de C1q que se haya unido a un complejo antígeno-anticuerpo.
Si la Cascada de Activación del Complemento se lleva a cabo correctamente, se forman tantos poros a lo largo de toda la superficie del antígeno que simplemente no puede lidiar con ese ataque. Esta es la razón por la que el Sistema del Complemento representa una de las lineas de defensa más importantes contra microorganismos invasores.
La MBL pertenece a una familia de proteínas llamadas Colectinas que a su vez se agrupan dentro de las llamadas Proteínas de Fase Aguda, cuya concentración aumenta durante un proceso inflamatorio. La estructura tridimensional de la MBL es similar a la de la proteína C1q que activa la Vía Clásica, por lo que su función es equivalente. Una vez que la MBL reconoce a las moléculas de Manosa presentes en los antígenos, se unen un par de proteasas conocidas como Serin-Proteasas Asociadas a MBL o MASP (por sus siglas en inglés MBL Associated Serine Proteases).
Las proteasas MASP tienen la función análoga a las proteínas C1s y C1r de la Vía Clásica, por lo que también rompen a las proteínas C2 y C4, que a su vez formarán la Convertasa de C3 (complejo C4b2b) capaz de romper a la proteína C3 en sus porciones C3a (porción pequeña que difunde por el plasma) y la porción C3b que se queda unida a la superficie del antígeno y cuya acumulación favorecerá la formación de la Convertasa de C5 (complejo C4b2b3b). La ruptura de la proteína C5 por medio de la Convertasa de C5 origina los fragmentos C5a (fragmento pequeño que difunde) y el C5b (fragmento grande) que favorecerá la formación del Complejo de Ataque a Membrana (MAC) de la misma manera que se ha explicado previamente en la Vía Clásica.
Como podemos apreciar, la cascada de activación por la vía de las Lectinas es similar a la Vía Clásica excepto por el tipo de reconocimiento del antígeno. En la Vía Clásica, el antígeno se reconoce mediante un anticuerpo al cual se une la C1q y luego las proteasas C1s y C1r, mientras que en la vía de las Lectinas el reconocimiento es por la MBL (que reconoce a las Manosas) a la que se unen las proteasas MASP.
Hay un aspecto muy importante que es necesario recalcar: El reconocimiento del antígeno por los anticuerpos es específico para cada antígeno, además de que depende de la existencia previa de ese tipo de anticuerpo, es decir, de la activación de Linfocitos B que hayan reconocido al antígeno. Por otro lado, la activación del complemento por la MBL es inespecífica debido a que las Manosas están presentes en diversos antígenos como bacterias, algunos virus con membrana y ciertos hongos como Candida albicans. Debido a esto, la vía clásica está más ligada a la respuesta inmune adaptativa, mientras que la vía de las Lectinas representa un mecanismo de la respuesta inmune innata.
La ruptura espontánea de C3 genera los fragmentos C3a y C3b, cuyas funciones son las mismas que hemos descrito para las otras vías de activación. La C3b formada de esta manera se encuentra en una forma activa-intermedia denominada C3b-(H2O) que tiene afinidad por otra proteína del Complemento llamada "Factor B". La unión de estas dos proteínas forma un complejo llamado C3b(H2O)B. Esta unión genera un cambio conformacional en el Factor B que expone un grupo de aminoácidos que sirve como sitio de corte para una proteína del complemento llama "Factor D" que tiene actividad enzimática de tipo proteasa, por lo que rompe al Factor B.
La ruptura del Factor B libera un fragmento pequeño "Ba" que difunde por el plasma, y un fragmento grande "Bb" que permanece unido a la proteína "C3b", formando un complejo proteico denominado "C3bBb" que es capaz de unirse a la superficie de los antígenos, La C3bBb tiene actividad enzimática de Convertasa de C3, por lo que romperá muchas moléculas de C3 (ahora de manera enzimática, ya no espontáneamente). Esta Convertasa de C3 (C3bBb) tiene una vida media muy corta, pero puede ser estabilizada mediante la unión con una proteína plasmática llamada Properdina (o "Factor P"). La Properdina es producida por los Neutrófilos y liberada cuando son activados por la presencia de antígenos.
La ruptura enzimática de "C3" genera muchos fragmentos de "C3a" (que difunden) y "C3b" que se acumulan en la superficie del antígeno. Como ocurre en las otras vías, la C3b acumulada se puede unir a la Convertasa de C3 y en este caso formar el complejo "C3bBb3b" con actividad enzimática de Convertasa de C5 que, como es de esperar, rompe a la proteína C5 en sus fragmentos "C5a" y "C5b". Igual que en las otras vías, la C5a difunde por el plasma mientras que la C5b se acumula en la superficie del antígeno e iniciará la formación del Complejo de Ataque a Membrana (MAC) como se explicó en la vía común.
Es necesario resaltar que la Convertasa de C3 de las Vías Clásica y de Lectinas (C4b2b) es análoga a la Convertasa de C3 de la Vía Alterna (C3bBb) y que la Convertasa de C5 de las Vías Clásica y de Lectinas (C4b2b3b) es análoga a la Convertasa de C3 de la Vía Alterna (C3bBb3b).
En este contexto, podemos ver que la Cascada del Complemento se activará por la Vía Clásica cuando se trate de un antígeno que ya se ha "identificado previamente", es decir, para el cual ya hay anticuerpos que han sido producidos previamente por Linfocitos B activados.
Por otro lado, ¿Qué pasaría si no hay anticuerpos específicos para un determinado antígeno?, no se activaría la Vía Clásica y estaríamos a merced de ese microorganismo. Pero afortunadamente existe la Vía de Lectinas, que se activará de manera independiente de la existencia o no de anticuerpos. Las Lectinas reconocen a Manosas, que están presentes en muchos microorganismos como bacterias, virus y hongos. Debemos recordar que este reconocimiento de antígenos es "inespecífico", pero es suficiente para activar la Vía de Lectinas y producir anafilotoxinas (C3a y C5a), así como el MAC.
¿Y si el antígeno no tuviera Manosas?. Existe la vía alterna, cuya activación no depende de alguna molécula en particular presente en el antígeno. La proteína C3 se puede activar de manera espontánea y activar la Cascada del Complemento para producir anafilotoxinas y formar el MAC.
Probablemente, querido lector, ya te diste cuenta que las células de nuestro cuerpo corren un gran riesgo al existir una forma de activar el MAC que no dependa de la presencia de antígenos específicos, ya que se puede activar en las células de nuestro cuerpo. Por otro lado, podría darse el caso de que algún anticuerpo reconociera algún componente de nuestras células, activando la Vía Clásica del Complemento. Eso es cierto, pero afortunadamente contamos con mecanismos de regulación del Sistema del Complemento para que esto no ocurra.
Ver también: Inflamación
BIBLIOGRAFIA
Aleshin, A. E., Schraufstatter, I. U., Stec, B., Bankston, L. A., Liddington, R. C., & DiScipio, R. G. (2012). Structure of Complement C6 Suggests a Mechanism for Initiation and Unidirectional, Sequential Assembly of Membrane Attack Complex (MAC). Journal of Biological Chemistry, 287(13), 10210-10222.
Ali, Y. M., Lynch, N. J., Haleem, K. S., Fujita, T., Endo, Y., Hansen, S., ... & Schwaeble, W. J. (2012). The lectin pathway of complement activation is a critical component of the innate immune response to pneumococcal infection. PLoS pathogens, 8(7), e1002793.
Bajic, G., Degn, S. E., Thiel, S., & Andersen, G. R. (2015). Complement activation, regulation, and molecular basis for complement‐related diseases. The EMBO journal, 34(22), 2735-2757.
Bayly-Jones, C., Bubeck, D., & Dunstone, M. A. (2017). The mystery behind membrane insertion: a review of the complement membrane attack complex. Philosophical Transactions of the Royal Society B: Biological Sciences, 372(1726), 20160221.
Bohlson, S. S., Garred, P., Kemper, C., & Tenner, A. J. (2019). Complement nomenclature—deconvoluted. Frontiers in immunology, 10, 1308.
Garred, P., Genster, N., Pilely, K., Bayarri‐Olmos, R., Rosbjerg, A., Ma, Y. J., & Skjoedt, M. O. (2016). A journey through the lectin pathway of complement—MBL and beyond. Immunological reviews, 274(1), 74-97.
Johnson, R. J. (2020). The complement system. In Biomaterials Science (pp. 777-790). Academic Press.
Martinez‐Pomares, L. (2012). The mannose receptor. Journal of leukocyte biology, 92(6), 1177-1186.
Nesargikar, P., Spiller, B., & Chavez, R. (2012). The complement system: history, pathways, cascade and inhibitors. European Journal of Microbiology and Immunology, 2(2), 103-111.
Nonaka, M. (2001). Evolution of the complement system. Current Opinion in Immunology, 13(1), 69-73.
Pedersen, D. V., Gadeberg, T. A., Thomas, C., Wang, Y., Joram, N., Jensen, R. K., ... & Andersen, G. R. (2019). Structural basis for properdin oligomerization and convertase stimulation in the human complement system. Frontiers in immunology, 10, 2007.
Peng, Q., Li, K., Sacks, S. H., & Zhou, W. (2009). The role of anaphylatoxins C3a and C5a in regulating innate and adaptive immune responses. Inflammation & Allergy-Drug Targets (Formerly Current Drug Targets-Inflammation & Allergy)(Discontinued), 8(3), 236-246.
Se denomina así debido a unos estudios hechos en la década de 1980 donde se observó que había ciertas proteínas, diferentes de los anticuerpos, que participaban en la destrucción de bacterias de Vibrio cholerae. A estas proteínas se les llamó "Complemento", ya que complementaban la función de los anticuerpos, es decir, los anticuerpos eran capaces de unirse a las bacterias pero incapaces de destruirlos, mientras que las proteínas del complemento sí podían destruir a las bacterias.
Actualmente conocemos los mecanismos y detalles de toda esta cascada del complemento, sabemos que también participa en otros procesos, como la inflamación, y está relacionada estrechamente con la respuesta inmune innata y adaptativa. Como veremos a detalle más adelante, la cascada del complemento puede ser iniciada por otras proteínas diferentes de los anticuerpos como las proteínas de fase aguda y receptores de reconocimiento de patrones moleculares asociados a patógenos (PAMP's, por sus siglas en inglés Pathogen Associated Molecular Patterns ).
El Sistema del Complemento comprende unas 40 proteínas que se encuentran en el plasma o unidas a la membrana de las células. Son producidas en el hígado y por algunos macrófagos activados durante el proceso de inflamación. Otras células capaces de producir proteínas del Complemento en un determinado momento incluyen a Monocitos sanguíneos y algunas células epiteliales de mucosas. Las proteínas se producen en sus formas inactivas y requieren de la participación de otras enzimas para activarse mediante la eliminación de una porción o fragmento.
Los componentes del Sistema del Complemento se designan con la letra "C" y un número, por ejemplo C1, C2, C3, etc., hasta C9. A algunas de ellas les denomina "factores", por ejemplo el "factor B" o el "factor D". A los fragmentos que se forman por la activación de algún componente se les designa con una letra minúscula, por ejemplo "C3a" o "C5b". En la mayoría de las proteínas, los fragmentos designados con la letra "a" son pequeños y solubles, mientras que los denominados con las letras "b" son grandes y se pueden adherir a la superficie de los antígenos.
Es importante señalar que durante muchos años se consideró una excepción con la proteína C2, donde el fragmento "C2a" era el grande y el "C2b" era el pequeño. Esto ha causado mucha confusión a lo largo de los años, por lo que se ha propuesto cambiar la designación, es por eso que algunos textos y artículos ya manejan a "C2a" como el fragmento pequeño y a "C2b" como el grande [Bohlson, et tal, 2019]. Sin embargo, este cambio aún no está universalmente aceptado, por lo que en algunos documentos aún se maneja a C2a como el fragmento grande y C2b como el pequeño. Nosotros lo manejaremos como lo marca la propuesta: C2a como fragmento pequeño y C2b como fragmento grande.
Las proteínas del Complemento participan en cuatro funciones que son: lisis de células bacterianas, opsonización de antígenos, activación de la respuesta inflamatoria y limpieza de complejos antígeno-anticuerpo.
Funciones del Sistema del Complemento: Lisis celular
El Sistema del Complemento activa una serie de proteínas que culmina en la formación de un poro sobre la superficie de los antígenos, que pueden ser células eucariontes de algún patógeno, células bacterianas y los virus con envoltura, es decir, virus que poseen una membrana proveniente de la célula que infectan.El poro formado al final de la Cascada del Complemento tiene un diámetro interno de unos 100 ángstroms (100 Å, un ángstroms equivale a 1x10-9 metros), suficiente para que las moléculas pequeñas como la glucosa, aminoácidos, iones, ATP, etc., puedan salir de la célula y causar un colapso metabólico que termina matando a la célula. Se piensa que la enzima lisozima que degrada el peptidoglucano de la pared celular de las bacterias podría pasar por el poro formado en la membrana externa de las bacterias Gram-negativas y acceder a la pared celular, sin embargo es necesaria más evidencia al respecto.
A pesar de que hablamos de "la formación del poro" sobre la membrana celular, en realidad se forman miles o incluso millones de ellos sobre la superficie en la que se activó el sistema del complemento, de tal manera que la célula queda literalmente "llena de hoyos".
Funciones del Sistema del Complemento: Opsonización
La opsonización es un proceso mediante el cual los antígenos son rodeados por proteínas. Esta interacción favorece el reconocimiento de ese antígeno y su eliminación mediante la fagocitosis.Durante la Cascada del Complemento, se generan proteínas activas que tienen la capacidad de unirse a la superficie del antígeno, las principales son C3b y C5b. Debido a que el Sistema del Complemento se activa en forma de cascada, en un momento dado se han producido miles de millones de proteínas activas C3b y C5b, muchas de estas se quedan unidas a la superficie de los antígenos.
Existen otras proteínas capaces de llevar a cabo el proceso de opsonización. Los más importantes son los anticuerpos que, al estar presentes en grandes cantidades, son capaces de unirse a los antígenos. Las células fagocíticas como Macrófagos, Células Dendríticas, Neutrófilos, entre otros, reconocen a las proteínas que están opsonizando a los antígenos y los fagocitan.
Funciones del Sistema del Complemento: Activación de la inflamación
La inflamación es un proceso complejo que puede ser activado de diversas maneras, una de ellas es por la presencia de las proteínas del Sistema del Complemento C3a y C5a. Cuando se activa la Cascada del Complemento se producen estas proteínas que se unen a Mastocitos y Macrófagos. Estas dos células son capaces de inducir el proceso inflamatorio local liberando histamina y Citocinas inflamatorias.Funciones del Sistema del Complemento: Limpieza de complejos Antígeno-Anticuerpo
Los complejos antígeno-anticuerpo (abreviados como Ag-Ab) son aglomerados que se forman cuando los anticuerpos son capaces de reconocer a ciertos antígenos y se quedan unidos a ellos con alta afinidad. Su presencia en el torrente sanguíneo puede ser peligrosa ya que si se acumulan podrían llegar a obstruir los capilares más delgados.El mecanismo más eficiente para la eliminación de complejos antígeno-anticuerpo es mediante la fagocitosis llevada a cabo por células del sistema inmune que se encuentran patrullando el organismo. Sin embargo, existe otro mecanismo de eliminación de estos complejos mediada por la participación el Sistema del Complemento. Cuando se forman los complejos Ag-Ab, algunas proteínas del Complemento favorecen la unión de estos complejos a la superficie de los glóbulos rojos que en algún momento de su trayecto pasarán por bazo, en donde liberarán los complejos Ag-Ab para que puedan ser fagocitados por los macrófagos esplénicos (macrófagos del bazo).
Activación de la Cascada del Complemento: Vía Clásica
La activación de la cascada enzimática del Sistema del Complemento se puede llevar de tres maneras, llamadas vía clásica, vía de lectinas y vía alterna o alternativa. A continuación veremos la vía clásica.La Vía Clásica de activación del Complemento fue la primera que se descubrió, por eso se le denomina "clásica". Inicia cuando anticuerpos, normalmente de isotipos IgM o IgG, se unen a la superficie de algún antígeno que han reconocido. La activación de esta vía requiere que varios anticuerpos se encuentren muy cerca unos de otros sobre la superficie del antígeno. En este sentido, la IgM al ser pentamérica, representa el principal anticuerpo capas de activar al Complemento por la vía clásica, mientras que la IgG es el anticuerpo más abundante en el plasma por lo que hay suficiente para activar al Complemento. La formación de este complejo Antígeno-Anticuerpo es reconocido por una proteína del Complemento denominada "C1q".
La cascada de activación por la vía clásica también se puede activar de otras maneras, aunque en menor proporción. La presencia de la Proteína C Reactiva, Proteína Amilóide Sérica, fibras amilóides así como cuerpos apoptóticos pueden activar la Vía Clásica.
La proteína C1q tiene una forma simétrica con seis brazos distribuidos de manera helicoidal cuyas puntas se unen a los dominios CH2 de los anticuerpos. La C1q permite que se unan otras dos proteínas llamadas "C1s" y "C1r", estas dos son enzimas proteasas que se activan la una a la otra, de hecho son dos enzimas de C1s y dos de C1r. La unión de todas estas proteínas forma un complejo denominado "C1qs2r2" (también C1qsrsr) cuya estabilidad requiere de la presencia de iones de Calcio.
El complejo C1qsrsr tiene actividad catalítica de tipo proteasa y es capaz de romper a otras proteínas del Complemento para activarlas. Una de ellas es la proteína C2 (que se rompe en un fragmento grande llamado C2b y fragmento pequeño llamado C2a*), y la otra es la C4 (que se rompe en un fragmento grande llamado C4b y fragmento pequeño llamado C4a). El número asignado a las proteínas del complemento está en función de su descubrimiento y no necesariamente refleja el orden en el que funcionan.
Los fragmentos pequeños C2a y C4a difunden por el plasma y funcionan como mediadores de inflamación, mientras que los fragmentos grandes C2b y C4b se unen para formar un complejo proteico que también tiene actividad enzimática. Este complejo se denomina "C4bC2b"* pero para simplificar un poco la nomenclatura se le conoce como "C4b2b" y la función que tiene es romper a la proteínas del complemento "C3", por lo que también recibe el nombre de "C3-Convertasa" o "Convertasa de C3".
* recordemos que anteriormente se denominaba C2a al fragmento grande, por lo que la convertasa de C3 solía denominarse como C4bC2a o C4b2a.
La Convertasa de C3 rompe a la proteína C3 en un fragmento pequeño "C3a" y uno grande "C3b". El fragmento C3a difunde en el plasma y funciona como molécula quimio-atractora de Neutrófilos, Macrófagos y Linfocitos, además de ser un potente activador de Mastocitos, influyendo de esta manera en el proceso inflamatorio, razón por la que a estas proteínas se les conoce como anafilotoxinas. El fragmento C3b se acumula en la proximidad del sitio en donde se activó la Vía Clásica mediante C1q. Esta proteína C3b se une a la superficie del antígeno y funciona como opsonina. La acumulación de la C3b favorece que algunas de estas moléculas se unan al complejo catalítico C4b2b (C3 Convertasa), generando un complejo más grande denominado "C4b2b3b" cuya función es romper a la proteína "C5" por lo que recibe el nombre de "C5-Convertasa" o "Convertasa de C5".
La ruptura de la proteína C5 por la C5-Convertasa genera dos fragmentos, uno pequeño denominado "C5a" (que difunde y actúa igual que C3a) y un fragmento grande llamado "C5b" que se adhiere a la superficie del antígeno y participa en el resto de la Cascada del Complemento hasta formar el poro que se mencionó al inicio de esta página. Este poro se conoce como Complejo de Ataque a Membrana o MAC (por sus siglas en inglés Membrane Attack Complex).
Formación del Complejo de Ataque a Membrana o MAC
Esta etapa de la formación del Complejo de Ataque a Membrana es igual en las tres vías de activación del complemento, por lo que en ocasiones se le menciona como la Vía Común. La proteína C5b es relativamente inestable y se puede degradar con rapidez, sin embargo, tiene afinidad por la proteína "C6" con la que forma un complejo estable. Estas dos proteínas se pueden unir a los componentes del complemento "C7", "C8" y a varias proteínas "C9" para formar un complejo proteico denominado C5b678(9)n, también conocido como Complejo de Ataque a Membrana o MAC, y es capaz de incrustarse en la membrana del antígeno. El MAC es un poro de 100 Å de diámetro que permite la salida indiscriminada de moléculas pequeñas y iones que afectan la capacidad osmótica de la célula, que finalmente muere.Se requieren de 10 a 17 proteínas C9 para formar un sólo Complejo de Ataque a Membrana. Además, cada complejo catalítico de C5-Convertasa producirá cientos de miles de proteínas C5b, cada una de ellas con el potencial de formar un MAC. Recordemos también que se han formado múltiples Convertasas de C3, lo que magnifica enormemente la formación del MAC a partir de una sola molécula de C1q que se haya unido a un complejo antígeno-anticuerpo.
Si la Cascada de Activación del Complemento se lleva a cabo correctamente, se forman tantos poros a lo largo de toda la superficie del antígeno que simplemente no puede lidiar con ese ataque. Esta es la razón por la que el Sistema del Complemento representa una de las lineas de defensa más importantes contra microorganismos invasores.
Activación de la Cascada del Complemento: Vía de Lectinas
Como su nombre lo indica, la activación de la cascada del complemento por la Vía de las Lectinas requiere de unas proteínas especiales llamadas Lectinas. Las Lectinas son proteínas que pueden reconocer carbohidratos y unirse estrechamente a ellos. La Lectina que inicia la cascada de activación del complemento reconoce a la Manosa, un carbohidrato de tipo aldehído con 6 átomos de carbono. Debido a que esta Lectina reconoce a la Manosa, se le denomina Lectina de Unión a Manosa o MBL (por sus siglas en inglés Mannose Binding Lectin). Existen otras proteínas llamadas ficolinas que también pueden activar esta vía, su estructura es similar a la MBL.La MBL pertenece a una familia de proteínas llamadas Colectinas que a su vez se agrupan dentro de las llamadas Proteínas de Fase Aguda, cuya concentración aumenta durante un proceso inflamatorio. La estructura tridimensional de la MBL es similar a la de la proteína C1q que activa la Vía Clásica, por lo que su función es equivalente. Una vez que la MBL reconoce a las moléculas de Manosa presentes en los antígenos, se unen un par de proteasas conocidas como Serin-Proteasas Asociadas a MBL o MASP (por sus siglas en inglés MBL Associated Serine Proteases).
Las proteasas MASP tienen la función análoga a las proteínas C1s y C1r de la Vía Clásica, por lo que también rompen a las proteínas C2 y C4, que a su vez formarán la Convertasa de C3 (complejo C4b2b) capaz de romper a la proteína C3 en sus porciones C3a (porción pequeña que difunde por el plasma) y la porción C3b que se queda unida a la superficie del antígeno y cuya acumulación favorecerá la formación de la Convertasa de C5 (complejo C4b2b3b). La ruptura de la proteína C5 por medio de la Convertasa de C5 origina los fragmentos C5a (fragmento pequeño que difunde) y el C5b (fragmento grande) que favorecerá la formación del Complejo de Ataque a Membrana (MAC) de la misma manera que se ha explicado previamente en la Vía Clásica.
Como podemos apreciar, la cascada de activación por la vía de las Lectinas es similar a la Vía Clásica excepto por el tipo de reconocimiento del antígeno. En la Vía Clásica, el antígeno se reconoce mediante un anticuerpo al cual se une la C1q y luego las proteasas C1s y C1r, mientras que en la vía de las Lectinas el reconocimiento es por la MBL (que reconoce a las Manosas) a la que se unen las proteasas MASP.
Hay un aspecto muy importante que es necesario recalcar: El reconocimiento del antígeno por los anticuerpos es específico para cada antígeno, además de que depende de la existencia previa de ese tipo de anticuerpo, es decir, de la activación de Linfocitos B que hayan reconocido al antígeno. Por otro lado, la activación del complemento por la MBL es inespecífica debido a que las Manosas están presentes en diversos antígenos como bacterias, algunos virus con membrana y ciertos hongos como Candida albicans. Debido a esto, la vía clásica está más ligada a la respuesta inmune adaptativa, mientras que la vía de las Lectinas representa un mecanismo de la respuesta inmune innata.
Activación de la Cascada del Complemento: Vía Alterna
La Vía Alterna de activación del Sistema del Complemento es independiente de las Vías Clásica y de Lectinas, sin embargo, comparte la etapa de formación del Complejo de Ataque a Membrana (la llamada Vía Común). La activación de la Vía Alterna inicia con la proteína C3 presente en el plasma. Esta proteína, de manera natural, puede sufrir una ruptura espontánea a una tasa muy baja, pero suficiente para iniciar el proceso de activación del Complemento.La ruptura espontánea de C3 genera los fragmentos C3a y C3b, cuyas funciones son las mismas que hemos descrito para las otras vías de activación. La C3b formada de esta manera se encuentra en una forma activa-intermedia denominada C3b-(H2O) que tiene afinidad por otra proteína del Complemento llamada "Factor B". La unión de estas dos proteínas forma un complejo llamado C3b(H2O)B. Esta unión genera un cambio conformacional en el Factor B que expone un grupo de aminoácidos que sirve como sitio de corte para una proteína del complemento llama "Factor D" que tiene actividad enzimática de tipo proteasa, por lo que rompe al Factor B.
La ruptura del Factor B libera un fragmento pequeño "Ba" que difunde por el plasma, y un fragmento grande "Bb" que permanece unido a la proteína "C3b", formando un complejo proteico denominado "C3bBb" que es capaz de unirse a la superficie de los antígenos, La C3bBb tiene actividad enzimática de Convertasa de C3, por lo que romperá muchas moléculas de C3 (ahora de manera enzimática, ya no espontáneamente). Esta Convertasa de C3 (C3bBb) tiene una vida media muy corta, pero puede ser estabilizada mediante la unión con una proteína plasmática llamada Properdina (o "Factor P"). La Properdina es producida por los Neutrófilos y liberada cuando son activados por la presencia de antígenos.
La ruptura enzimática de "C3" genera muchos fragmentos de "C3a" (que difunden) y "C3b" que se acumulan en la superficie del antígeno. Como ocurre en las otras vías, la C3b acumulada se puede unir a la Convertasa de C3 y en este caso formar el complejo "C3bBb3b" con actividad enzimática de Convertasa de C5 que, como es de esperar, rompe a la proteína C5 en sus fragmentos "C5a" y "C5b". Igual que en las otras vías, la C5a difunde por el plasma mientras que la C5b se acumula en la superficie del antígeno e iniciará la formación del Complejo de Ataque a Membrana (MAC) como se explicó en la vía común.
Es necesario resaltar que la Convertasa de C3 de las Vías Clásica y de Lectinas (C4b2b) es análoga a la Convertasa de C3 de la Vía Alterna (C3bBb) y que la Convertasa de C5 de las Vías Clásica y de Lectinas (C4b2b3b) es análoga a la Convertasa de C3 de la Vía Alterna (C3bBb3b).
Importancia de tener tres vías de activación de la Cascada del Complemento
Lo que más resalta de la Cascada del Complemento es que hay tres vías de activación, ¿Qué ventaja representa para los organismos tener tres formas de activar a la Cascada del Complemento?. Como se mencionó al principio, la Cascada del Complemento representa una linea de defensa muy importante frente a patógenos, sobre todo de bacterias, por lo que es muy importante garantizar que el complemento se activará en presencia de antígeno.En este contexto, podemos ver que la Cascada del Complemento se activará por la Vía Clásica cuando se trate de un antígeno que ya se ha "identificado previamente", es decir, para el cual ya hay anticuerpos que han sido producidos previamente por Linfocitos B activados.
Por otro lado, ¿Qué pasaría si no hay anticuerpos específicos para un determinado antígeno?, no se activaría la Vía Clásica y estaríamos a merced de ese microorganismo. Pero afortunadamente existe la Vía de Lectinas, que se activará de manera independiente de la existencia o no de anticuerpos. Las Lectinas reconocen a Manosas, que están presentes en muchos microorganismos como bacterias, virus y hongos. Debemos recordar que este reconocimiento de antígenos es "inespecífico", pero es suficiente para activar la Vía de Lectinas y producir anafilotoxinas (C3a y C5a), así como el MAC.
¿Y si el antígeno no tuviera Manosas?. Existe la vía alterna, cuya activación no depende de alguna molécula en particular presente en el antígeno. La proteína C3 se puede activar de manera espontánea y activar la Cascada del Complemento para producir anafilotoxinas y formar el MAC.
Probablemente, querido lector, ya te diste cuenta que las células de nuestro cuerpo corren un gran riesgo al existir una forma de activar el MAC que no dependa de la presencia de antígenos específicos, ya que se puede activar en las células de nuestro cuerpo. Por otro lado, podría darse el caso de que algún anticuerpo reconociera algún componente de nuestras células, activando la Vía Clásica del Complemento. Eso es cierto, pero afortunadamente contamos con mecanismos de regulación del Sistema del Complemento para que esto no ocurra.
Ver también: Inflamación
Temas Selectos de Ciencias.
Sistema Inmunitario, reconociendo lo propio de lo ajeno.
Sistema Inmunitario, reconociendo lo propio de lo ajeno.
Ir al MAPA DEL SITIO para ver contenido de otras áreas (Bioquímica, Inmunología, Biología...)
BIBLIOGRAFIA
Aleshin, A. E., Schraufstatter, I. U., Stec, B., Bankston, L. A., Liddington, R. C., & DiScipio, R. G. (2012). Structure of Complement C6 Suggests a Mechanism for Initiation and Unidirectional, Sequential Assembly of Membrane Attack Complex (MAC). Journal of Biological Chemistry, 287(13), 10210-10222.
Ali, Y. M., Lynch, N. J., Haleem, K. S., Fujita, T., Endo, Y., Hansen, S., ... & Schwaeble, W. J. (2012). The lectin pathway of complement activation is a critical component of the innate immune response to pneumococcal infection. PLoS pathogens, 8(7), e1002793.
Bajic, G., Degn, S. E., Thiel, S., & Andersen, G. R. (2015). Complement activation, regulation, and molecular basis for complement‐related diseases. The EMBO journal, 34(22), 2735-2757.
Bayly-Jones, C., Bubeck, D., & Dunstone, M. A. (2017). The mystery behind membrane insertion: a review of the complement membrane attack complex. Philosophical Transactions of the Royal Society B: Biological Sciences, 372(1726), 20160221.
Bohlson, S. S., Garred, P., Kemper, C., & Tenner, A. J. (2019). Complement nomenclature—deconvoluted. Frontiers in immunology, 10, 1308.
Garred, P., Genster, N., Pilely, K., Bayarri‐Olmos, R., Rosbjerg, A., Ma, Y. J., & Skjoedt, M. O. (2016). A journey through the lectin pathway of complement—MBL and beyond. Immunological reviews, 274(1), 74-97.
Johnson, R. J. (2020). The complement system. In Biomaterials Science (pp. 777-790). Academic Press.
Martinez‐Pomares, L. (2012). The mannose receptor. Journal of leukocyte biology, 92(6), 1177-1186.
Nesargikar, P., Spiller, B., & Chavez, R. (2012). The complement system: history, pathways, cascade and inhibitors. European Journal of Microbiology and Immunology, 2(2), 103-111.
Nonaka, M. (2001). Evolution of the complement system. Current Opinion in Immunology, 13(1), 69-73.
Pedersen, D. V., Gadeberg, T. A., Thomas, C., Wang, Y., Joram, N., Jensen, R. K., ... & Andersen, G. R. (2019). Structural basis for properdin oligomerization and convertase stimulation in the human complement system. Frontiers in immunology, 10, 2007.
Peng, Q., Li, K., Sacks, S. H., & Zhou, W. (2009). The role of anaphylatoxins C3a and C5a in regulating innate and adaptive immune responses. Inflammation & Allergy-Drug Targets (Formerly Current Drug Targets-Inflammation & Allergy)(Discontinued), 8(3), 236-246.








Comentarios
Publicar un comentario